枯草芽袍杆菌(Bacillus subtilis)是革兰氏阳性细菌的典型代表,是一类好氧型、内生抗逆袍子的杆状细菌.其细胞壁组成简单,在合成过程中没有内毒素生成,已经被欧盟、日本、美国和中国认定为安全无毒的菌株,可广泛应用于食品、饲料等行业。芽袍(内生袍子或称袍子)是芽袍杆菌营养细胞受到营养缺乏,代谢产物积累,或温度变化等外部环境因子的触发而形成的体眠体,芽袍的形成需要经过一系列复杂的生理生化反应.
近年来以芽袍衣壳蛋白为分子载体,通过芽袍表而展示技术将外源目的蛋白展示在重组枯草芽袍杆菌芽袍表而,制备具有生物活性的重组芽袍抗体和酶制剂已成为人们研究和关注的热点。芽袍的结构相当复杂,中心部位为核芯,含有原生质体,被芽袍膜包裹;核芯外而为皮层,成分为肚聚糖,再往外是一层或者数层蛋白质组成的芽袍壳,最表而为芽袍壁。B. subhfis芽袍中约包含25种衣壳蛋白,而本研究前期已利用CotC为载体成功将海藻糖合酶展示在芽袍表而。但是由于芽袍易受萌发剂刺激而萌发,当芽袍萌发时首先会释放2,6-毗咤一梭酸钙CCaz+-dipicolinicacid Caz+-DPA)和大量离子,然后袍子皮层内的肚聚糖被水解,皮层水解会逐渐补充袍子核内的水分,最后芽袍恢复酶活力,导致衣壳蛋白被降解脱落,而海藻糖合酶相应脱落后也会被一些蛋白酶类降解,因此不仅失去了固定化酶的目的,还降低了海藻糖合酶酶活,加大其回收难度。所以,弱化芽袍萌发,钝化芽袍对外界环境刺激的感知变得尤为重要。本研究选择枯草芽袍杆菌芽袍萌发中的两个关键皮层溶解酶基因cwlJ和、IeB基因作为敲除对象,实现抑制芽袍萌发的目的,构建芽袍表而稳定展示海藻糖合酶的工程菌,提高芽袍的稳定性和利用率,更加高效稳定的表而展示海藻糖合酶。
1 材料与方法
1.1 材料与试剂
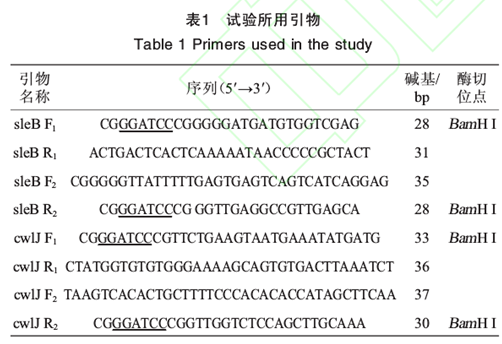
含有海藻糖合酶基因的枯草芽袍杆菌168(以下简称B. subtifis 168-Tres):本实验室保藏;含有卡那霉素抗性基因的质柳PIC9研口含有博来霉素抗性基因的质粒pPICZaA:杭州宝赛生物科技有限公司;限制性内切酶:日本TakaRa宝生物公司;卡那霉素、博来霉素、Ezup柱式基因组DNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒:上海生工生物工程有限公司;高纯度质粒小量快速提取试剂盒:艾德莱生物公司;其他试剂均属于国产分析纯。实验所涉及引物见表1所示。
LB培养基:酵母浸粉5 g/L、蛋白胨10 g/L,氯化钠10 g/L,pH 7.0-7.4 。
发酵培养基:葡萄糖10 g/L、玉米浆10 g/L,酵4浸粉3 g/L, NaCI 6 g/L, K2HP04 3 g/L, MnS04 0.3 g/L, MgS042.4 g/L, pH7.0-7.4 。
菌体增殖培养基:酵母浸粉5 g/L、蛋白陈10 g/L,氯化钠10 g/L、山梨醇91 g/L o
电转缓冲液:甘露醇91 g/L、山梨醇91 g/L、甘油100 g/10
菌体复苏培养基:酵母浸粉5 g/L、蛋白陈10 g/L,氯化钠10 g/L、甘露醇69 g/L、山梨醇91 g/L。
葡萄糖需在高压蒸汽灭菌锅中115℃灭菌20 min其他培养基均121 ℃灭菌20 min。
1.2 仪器与设备
SW – CJ - 2FD型双人单而净化工作台:苏州净化设备有限公司;WFJ 7200型可见分光光度计:尤尼柯(上海)仪器有限公司;5 804 R型离心机:德国Eppendorf公司;438℃型电转仪:德国Eppendorf公司;GNP - 9080型隔水式恒温培养箱:上海精宏实验设备有限公司;梯度PCR仪:美国应用生物系统公司;MD2000核酸超微量分光光度计:美国BioFuture公司;ZQYZ - CS型恒温振荡培养箱:上海知楚仪器有限公司。
1.3 实验方法
1.3.1重组同源性片段sleBl-kmr, cwIJ1-zeor的制备
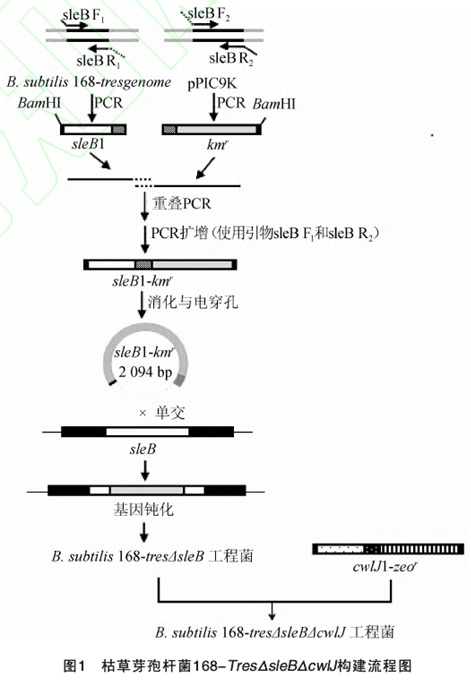
用Ezup柱式基因组DNA抽提试剂盒提取B. subtilis168-Tres菌体的脱氧核糖核酸(deoxyribose nucleic acidDNA),并以此为模板,sleB F1和sleB R1为引物进行聚合酶链反应(polymerise chain reaction PCR)扩增,获得长度为592 bp用于敲除sleB基因的同源臂sleBl;使用高纯度质粒小量快速提取试剂盒提取pPIC9k质粒,以此为模板,sleB F2和sleB R2为引物进行PCR扩增,获得长度为1 502 bp的卡那霉素抗性基因片段km`;使用SanPrep柱式DNA胶回收试剂盒胶回收所得的sleB 1片段与kmr片段为模板,sleB F1和sleB R2为引物进行重叠延伸PCR, PCR扩增条件为:(1)95 ℃预变性5 min; 94 ℃变性30 sec, 57 ℃退火30s,72℃延伸3.5 min, 5个循环;72 ℃延伸2 min; (2) 95 ℃预变性5 min94 ℃变性30s,56℃退火30s,72℃延伸4.5 min, 30个循环;72℃延伸10 min , 4℃保存,扩增得到长度为2 094 bp的同源重组片段sleBl -kmr,并使用SanPrep柱式DNA胶回收试剂盒进行胶回收,保存于-20℃备用。cwlJl长度为451 bp博来霉素抗性基因片段为1 205 bp,cwlJl-zeor片段制备方法同上。Bacillus subtifis 168-TresOsleBΔcwIJ工程菌构建流程见图1。
1.3.2 回收产物的酶切及浓缩
用限制性内切酶BamH I酶切sleB 1-kmr和 cwLll -zeor基因片段,并向酶切产物中加入1/10体积3 mol/L醋酸钠和2.5倍体积的无水乙醇,置于-20℃冰箱冷却20 min,然后12 000 r/min离心5 min得沉淀;加入300 μL体积分数为75%乙醇重悬沉淀,12 000 r/min离心5 min后除去乙醇,37℃风干30 min最后加入15-20 μLddHZO重悬DNA。使用核酸超微量分光光度计测定回收DNA质量浓度,并最终获得质量浓度在200-500 ng/μL之间的DNA溶液。
1.3.3 电转感受态细胞的制备
挑取新鲜LB固体培养基表而的B. subtifis 168-Tres单菌落,接种于10 mL菌体增殖培养基中,37 ℃,220 r/min培养12h;将上述菌液转接到50 mL菌体增殖培养基中至菌液初始OD600mm = 0.2,然后37 ℃,220 r/min培养菌体至OD600mm = 1.0;将菌液转移到100 mL离心管,冰浴10--15 min后,4 ℃ ,8 000 r/min离心5 min,收集菌体;离心后的菌体用预冷的电转缓冲液洗涤2--3次,并使用1 mL电转缓冲液重悬菌体,制成枯草芽袍杆菌电转化感受态[mo;将制备好的感受态细胞每管分装100 μL,-80℃保存备用。B. subtilis 168-TresasleB感受态的制备方法同上。
1.3.4 电转化
将回收片段sleBl-kmr与B. subtifis 168-Tres感受态混合均匀,然后加到2 mm电转杯中预冷5 min,并使用电转仪在2 000 V,5 ms条件下电转化,电转完成后立即加入500 μL菌体复苏培养基,37 ℃,180 r/min复苏培养3h后涂布在含卡那霉素(25 μg/mL)的LB 固体培养基中,于3 7 ℃恒温培养箱中培养1-2 d,筛选出抗卡那霉素的菌株。将cwlJl-zeor与B. subtifis 168-TresΔsleB感受态电转后,筛选出抗卡那霉素和博来霉素的菌株。
1.3.5 阳性重组菌株的鉴定及传代培养
挑取阳性转化子接种到含卡那霉素抗性的液体LB培养基中,37℃培养过夜后8 000 r/min离心并收集菌体,提取重组菌DNA,并以获得的基因组为模板,sleB FZ和sleB凡为引物进行PCR扩增,1%琼脂糖凝胶电泳检验PCR产物,获得阳性重组菌株B. subtilis 168-TresΔsleBo重组菌B. subtilis168-TresΔsleBΔcwIJ的获得方法同上。用LB液体培养基将B. subtilis 168-TresΔsleBΔcwIJ重组菌在3 7 ℃ , 200 r/min的培养条件下传代15次,做菌落PCR验证。
1.3.6 B. subtifis 168-TresΔsleBΔcwIJ重组菌芽抱形成检测
将原始菌株B. subtilis 168-Tre对口重组菌株B. subtilis168-TresΔsleBΔcwIJ以1%的接种量分别接种在发酵培养基中,置于37 ℃ , 200 r/min的恒温振荡培养箱中培养48 h,每隔4h取样,同时利用芽袍染色法对芽袍染色,置油镜观察,芽袍呈绿色,菌体成红色。观察10个视野的营养细菌与芽袍数,产芽袍率=芽袍数/(芽袍数+营养细胞数)x100%。
1.3.7 B. subtifis 168-TresΔsleBΔcwIJ重组菌在LB培养基中芽抱萌发验证
分别将发酵48 h后的重组菌与原始菌菌液80℃水浴20 min,立即冰浴,将菌体稀释后涂布在LB固体培养基中,放置在37 ℃'恒温培养箱中培养30 h,用平板计数法记录芽袍萌发结果。
1.3.8 B. subtifis 168-TresΔsleBΔcwIJ重组菌在麦芽糖转化体系中芽抱萌发验证
分别取5 mL发酵48 h后的重组菌与原始菌菌液80 ℃水浴20 min,立即冰浴,与10 mL pH 7.5的磷酸盐缓冲液配制的终浓度30%的麦芽糖浆混匀后制备成海藻糖合酶的反应体系。将此反应体系置于25 ℃恒温水浴振荡摇床中反应12h,每隔4h取样涂布在LB培养基中,放置在37℃恒温培养箱中培养30 h,用平板计数法记录芽袍萌发结果。
1.3.9 B. subtifis 168-TresΔsleBΔcwIJ重组菌在麦芽糖转化体系中海藻糖合酶酶活检测
分别将发酵48 h后的重组菌与原始菌发酵液8 000 r/min离心20 min,弃上清,用去离子水洗涤沉淀2次后并悬浮,加入溶菌酶使其终质量浓度为2 mg/mL后T-37℃放置30 min破坏营养细胞,后经8 000 r/min离心10 min,烘干,称量干菌体质量,最后用去离子水悬浮制得芽袍悬浮液,将5 mL芽袍悬浮液与10 mL pH 7.5的磷酸盐缓冲液配制的终浓度为30%的麦芽糖浆混匀,制备成海藻糖合酶的反应体系。将此反应体系置于25 ℃'恒温水浴振荡摇床中反应12h后,室温,1 000 r/min离心10 min取上清进行高效液相色谱Chigh performance liquid chromatography HPLC)检测转化体系中海藻糖。
HPLC测定色谱条件:Hypersil NHZ色谱柱(300 mmx4.6 mm 、5 μm);流动相(乙睛冰=3:1,V/功;流速1.0 mL/min;示差折光检测器:波}}589.3nm;进样量10 μL;柱温:40℃。
海藻糖合酶活力定义:在25 ℃ , pH 7.5条件下,每分钟生成1 μmol海藻糖所需的酶量为一个酶活单位(U)。
2结果与分析
2.1基因敲除片段sleB 1-kmrb勺构建、电转化及鉴定
以B. subtilis 168-Tres菌体的基因组为模板,sleB F,和sleB R,为引物进行PCR扩增,1%琼脂糖凝胶电泳检测,结果见图2a。由图2a可知,在600 bp左右出现特异性条带,与理论长度5 92 bp相符,表明已成功获得同源臂sleBl;以质粒pPIC9k为模板,sleB F2和sleB R2为引物进行PCR扩增,1%琼脂糖凝胶电泳检测,结果见图2b。由图2b可知,在1 500 bp左右出现特异性条带,与理论长度1 502 bp相符,表明成功获得卡那霉素抗性基因片段kmr;以胶回收制得的sleBl片段与kmr片段为模板,sleB F,和sleB R2为引物进行重叠延伸PCR,得基因敲除片段sleBl-kmr, 1%琼脂糖凝胶电泳检测PCR产物,结果见图2c。由图2c可知,在2 000 bp左右出现特异性条带,与理论长度2 094 bp相符,表明基因敲除片段sleBl -kmr构建成功。
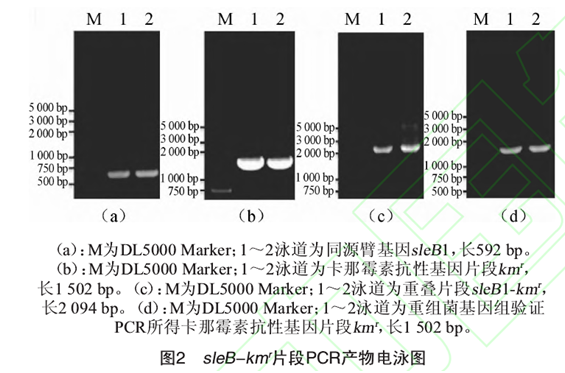
通过乙醇沉淀法浓缩酶切片段后,测得DNA质量浓度为395.63 ng/μL。将10 μL回收片段与100 N.,L B. subtifis168-Tres感受态细胞混合并电转,用引物sleB F2和sleB R2对含卡那霉素平板上生长的菌落基因组进行验证,结果如图2d所示,表明sleBl-kmr与sleB发生同源重组,完成sleB基因的敲除,获得B. subtifis 168-TresΔsleB重组菌。
2.2基因敲除片段cwlJl-zeor的构建、电转化及鉴定
以B. subtilis 168-Tres菌体的基因组为模板,cw1J F1和cw1J R1为引物进行PCR扩增,1%琼脂糖凝胶电泳检测结果见图3a。由图3a可知,在500 bp左右出现特异性条带,与理论长451 bp相符,表明已成功获得同源臂cwlJl;以质粒pPICZaA为模板,使用引物cw1J F2和cw1J R2进行PCR扩增,1%琼脂糖凝胶电泳检测结果见图3b。由图3b可知,在1200 bp左右出现特异性条带,与理论长度1 205 bp相符,表明成功获得博来霉素抗性基因片段zeor;以胶回收制得的cwlJl片段和zeor片段为模板,cw1J F1和cw1J R2为引物进行重叠延伸PCR,得基因敲除片段cwlJl-zeor, 1%琼脂糖凝胶电泳检验结果见图3c。由图3c可知,PCR产物,发现在1 700 bp左右出现特异性条带,与理论长度1 656 bp相符,表明基因敲除片段cwlJl-zeor构建成功。
通过乙醇沉淀法浓缩酶切片段后,测得DNA质量浓度为378.26 ng/μL。将10 μL回收片段与100 N.,L B. subtilis168-TresasleB感受态细胞混合并电转,用引物cw1J F2和cw1J凡对含km和zeo平板上生长的菌落基因组进行验证,结果如图3d所示,表明cwLll-zeor与cwlJ发生同源重组,完成cwlJ纂因的敲除,获得B. subtilis 168-TresΔsleBΔcwIJ重组菌。

2.3 B. subtifis 168-TresΔsleBΔcwIJ重组菌传代培养验证结果
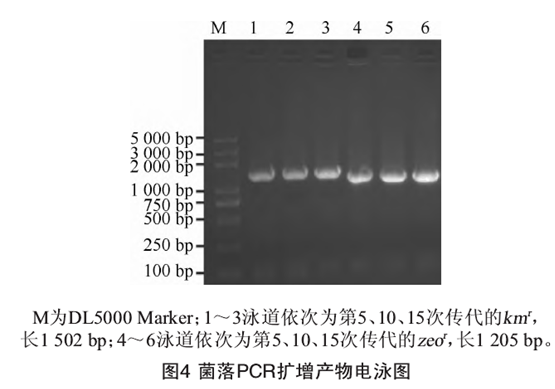
B. subtilis 168-TresΔsleBΔcwIJ重组菌第5,10,15次传代后的菌落PCR产物用1%琼脂糖凝胶电泳检测结果见图40由图4可知,第5,10,15次传代在1 500 bp和1 200 bp都有条带产生,与Icm和zeor的理论值相符,表明重组菌的遗传稳定性并未发生变化。
2.4 sleB, cwlJ基因双敲除后对芽袍形成的影响
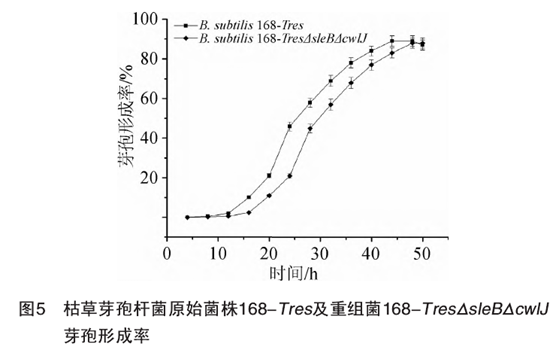
通过显微镜计数法计算原始菌株B. subtilis 168-Tres与重组菌B. subtilis 168-TresΔsleBΔcwIJ芽袍率,结果见图5.由图5可知,重组菌株比原始菌株生长迟缓约4 h,但两株菌在48 h后的芽袍形成率都约为88%,证明敲除sleB和cwlJ基因后会使菌体生长时间延迟,但芽袍形成率未发生变化。
2.5 B. subtilis 168-TresΔsleBΔcwIJ重组菌在LB培养基中芽袍萌发验证
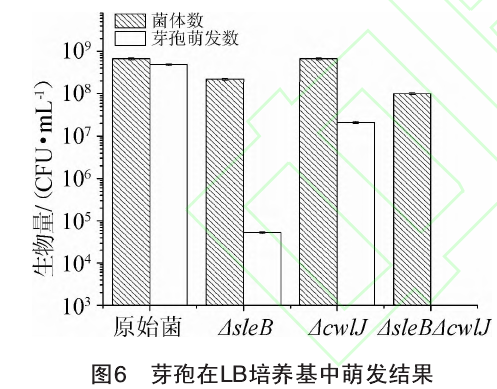
通过平板计数法对原始菌株和重组菌株芽袍萌发情况进行比较,结果见图6。由图6可知,B. subtifis 168-Tres芽袍萌发数为4.9x10 CFU/mL, B. subtifis 168-TresΔsleB芽袍萌发数为5.3 x104 CFU/mL, B. subtilis 168-TresΔcwlJ芽袍萌发数为2.1x107 CFU/mL, B. subtifis 168-TresΔsleBΔcwIJ芽袍未见萌发。
2.6 B. subtilis 168-TresΔsleBΔcwIJ重组菌在麦芽糖转化体系中芽袍萌发验证
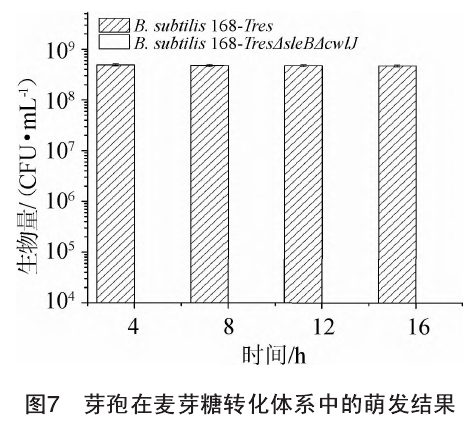
通过平板计数法对原始菌株B. subtifis 168-Tres和重组菌株B. subtilis 168-TresΔsleBΔcwIJ在麦芽糖转化体系中的芽袍萌发情况进行比较,结果见图7。由图7可知,原始菌株在麦芽糖转化体系中转化4h,8h,12h,16h后的芽袍萌发数都为4.8x108CFU/mL左右,而重组菌株芽袍在各个时段一直未见萌发。
2.7 B. subtilis 168-TresΔsleBΔcwIJ重组菌在麦芽糖转化体系中海藻糖合酶酶活检测
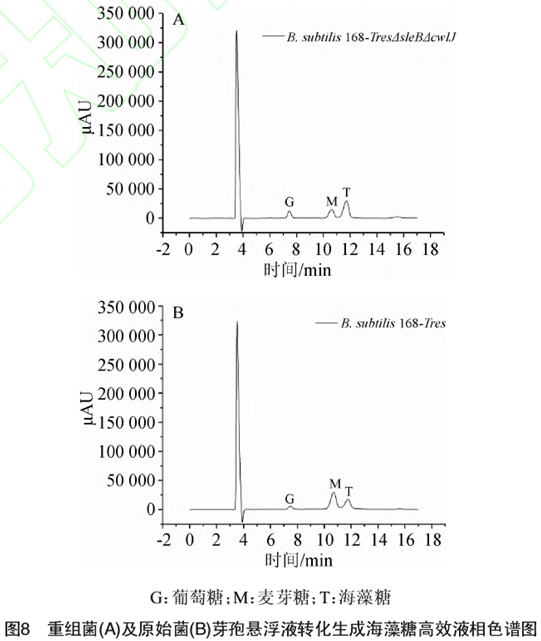
为了证实B. subtifis 168-TresΔsleBΔcwIJ重组菌海藻糖合酶酶活是否有所提高,利用HPLC对重组菌芽袍悬浮液进行海藻糖合酶检测,结果见图8。由图8可知,用B. subtifis168-Tres原始菌芽袍转化测得的海藻糖合酶酶活为5.83 U}用B. subtilis 168-TresΔsleBΔcwIJ重组菌芽袍转化测得的海藻糖合酶酶活为10.42 U}重组菌比原始菌酶活提高了78.7%,这表明敲除、IeB和cwlJ基因后弱化了芽袍萌发,成功提高了芽袍表而展示海藻糖合酶的稳定性。
3 结论
本研究通过构建敲除载体、IeB-kmr, cwlJ-zeor的方法来实现sleB和cwlJ基因的敲除。通过对构建的B. subtilis168-TresΔsleBΔcwIJ〔程菌初步研究,发现构建菌株与原始菌株相比,sleB和cwlJ基因的缺失对芽袍形成并无较大影响,但其芽袍萌发数有显著降低,在LB培养基和麦芽糖转化生成海藻糖体系中B. subtifis 168-Tres菌株芽袍萌发数为4.9x108 CFU/mL,而B. subtilis 168-TresΔsleBΔcwIJ菌株芽袍不萌发;经HPLC检测发现构建菌株的海藻糖合酶酶活比原始菌提高了78.7%,表明B. subtifis 168-TresΔsleBΔcwIJ工程菌已经构建成功。
目前国内外还未有对芽袍表而展示海藻糖合酶的研究,与其他生产海藻糖的菌株相比,芽袍表而展示海藻糖合酶具有以下特点:(1)避免诱导剂使用造成的限制,;(2)融合酶不需穿过细胞膜,避免了细胞破碎、分离等繁琐步骤,降低生产成本提高海藻糖产率;(3)芽袍比表而积较酶分子大,便于回收,可重复利用。本研究在其基础上对菌株进行改造,解决了芽袍表而展示海藻糖合酶时芽袍易受转化体系中的麦芽糖刺激而萌发,导致铆定在芽袍表而上的海藻糖合酶因芽袍萌发而失去活性的难题。sleB和cwlJ基因的敲除,成功的抑制了芽袍萌发,提高了芽袍的稳定性和利用率,为芽袍表而展示海藻糖合酶提供了稳定的载体,为海藻糖的工业化生产奠定基础。








